Řešení: a) pH roztoku kyseliny před přídavkem titrantu:
aktivita iontu: aH3O+ = 0,1 · 0,796 = 0,0796
mol·l-1
 pH =
1,10 pH =
1,10b) pH roztoku před bodem ekvivalence - koncentraci nevytitrované kyseliny vypočítáme z rozdílu látkových množství původní a ztitrované kyseliny
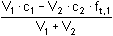
Po přídavku 1 ml 0,1M-NaOH (vytitrováno je 10% kyseliny):
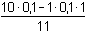 =
0,0818 mmol·ml-1 = mol·l-1 =
0,0818 mmol·ml-1 = mol·l-1
pH = 1,09
I = 0,0909 aH3O+ = 0,0818 · 0,762 =
0,0623 mol·l-1  pH =
1,20 pH =
1,20
Po přídavku 9,9 ml 0,1M-NaOH (vytitrováno 99% kyseliny):
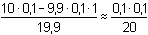 mol·l-1 pH = 3,30
mol·l-1 pH = 3,30
I = 0,05 aH3O+ = 5·10–4
· 0,807 = 4,035·10–4 mol·l-1
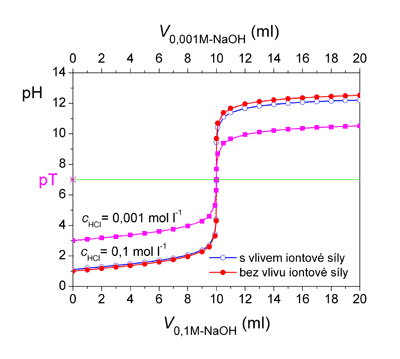
 pH = 3,39 pH = 3,39c) pH roztoku v bodě ekvivalence (pT) - přídavek 10 ml 0,01M-NaOH
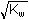 =
1·10–7 mol·l-1 pH = 7,00 =
1·10–7 mol·l-1 pH = 7,00
I = 0,05
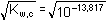 =
1,235·10–7 mol·l-1 =
1,235·10–7 mol·l-1
 pH = 6,91 pH = 6,91d) pH roztoku za bodem ekvivalence - koncentraci nadbytečného hydroxidu vypočítáme z rozdílu látkových množství hydroxidu a kyseliny
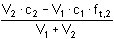
Po přídavku 11 ml 0,1M-NaOH (přebytek 10% NaOH)
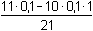 = 0,00476 mol·l-1 = 0,00476 mol·l-1
pOH = 1,32 pH = 12,68
I = 0,0524 aOH- = 0,00476 · 0,804 =
3,827·10-3 = 10–2,42 mol·l-1
pKw,c = 13,814 pH = 11,39
V případě acidimetrické titrace silného hydroxidu, výpočet pH (pOH) je zcela obdobný.
Titrační křivky pro titraci 10 ml kyseliny chlorovodíkové (koncentrace 0,1 mol·l-1 resp. 0,001 mol·l-1) odměrným roztokem hydroxidu sodného (koncentrace 0,1 mol·l-1 resp. 0,001 mol·l-1).
| ||