Řešení: a)
I = 0,02 f± = 0,860 (tab. 7)
aH3O+ = 0,02 · 0,860 = 0,0172 mol·l-1
pOH = 1,76
pH =
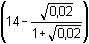 = (14 – 0,124) – 1,76 =
12,12 = (14 – 0,124) – 1,76 =
12,12
I = 1/2(4·10-4 · 22 + 8·10-4 ·
12) = 0,0012 f± = 0,922
aOH- = 8·10-4 · 0,922 =
7,376·10-4 mol·l-1 pOH = 3,13
pH = (14 - 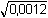 ) - 3,13 = (14 – 0,035) – 3,13
= 10,84 ) - 3,13 = (14 – 0,035) – 3,13
= 10,84
pH roztoku hydroxidu draselného je 12,12 a barnatého 10,84.
|
| |