Řešení: Sloučenina je ve vodě značně rozpustná, iontová síla roztoku bude tedy určena součinem rozpustnosti:
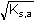 ) =
1/2 (2 ) =
1/2 (2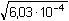 ) = 0,0246 ) = 0,0246
Podle vztahu (3):
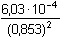 = 8,287·10-4 = 8,287·10-4
[AgNO2] = [Ag+] = [NO2-] =
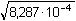 = 0,0288
mol·l-1 = 0,0288
mol·l-1Podle rovnice (14):
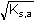 = = 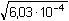 =
0,0246 mol·l-1 = 10-1,609 mol·l-1 =
0,0246 mol·l-1 = 10-1,609 mol·l-1
log [AgNO2] = -1,609 + 0,509 ·
[AgNO2] = 0,0288 mol·l-1
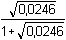 = -1,540
= -1,540Podle vztahu (5):
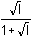 =
3,22 - 0,136 = 3,084 =
3,22 - 0,136 = 3,084
[AgNO2] = [Ag+] =
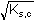 = =
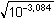 = 0,0287
mol·l-1 = 0,0287
mol·l-1Rozpustnost dusitanu stříbrného je 0,0288 mol·l-1, resp. 4,4315 g·l-1. | ||