Řešení: Rovnovážná konstanta reakce Ti3+ + Fe3+
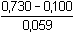 = 10,68 = 10,68
a) Za rovnovážného stavu je poměr koncentrací 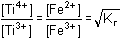 = 105,43 = 105,43
odtud
[Fe2+] = 105,34 [Fe3+]
Protože cTi = cFe = 0,005 mol·l-1
[Ti4+] + [Ti3+] = [Fe3+] + [Fe2+] = 0,005
mol·l-1,
pak
[Ti3+] = [Fe3+] = 0,005 / (1 + 105,34) =
2,285·10–8 mol·l-1
[Ti4+] = [Fe2+] ≈ 5·10–3 mol·l-1
b) Ke stejnému výsledku dospějeme řešením kvadratické rovnice:
(0,005 – [Fe3+])2 = 1010,68 [Fe3+]2
(1010,68 – 1) [Fe3+]2 + 0,01 [Fe3+] – (0,005)2 = 0
[Fe3+] = [Ti3+] = 2,29·10–8 mol·l-1
Koncentrace nezreagovaných složek je zanedbatelná (2,29·10–8 mol·l-1), průběh reakce je kvantitativní. | ||
 Ti4+ + Fe2+ bude podle
Ti4+ + Fe2+ bude podle