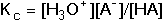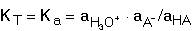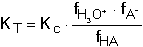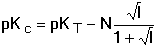| |||||
|
5.3. Výpočet pH slabých elektrolytů Slabé kyseliny a slabé zásady jsou ve vodě disociovány pouze zčásti, do určitého stupně.
V roztoku se ustavuje protolytická rovnováha, kterou podle Guldberg-Waagova zákona lze
charakterizovat příslušnou disociační konstantou - koncentrační Kc, nebo
termodynamickou KT. které jsou často z praktických důvodů zapisovány ve zjednodušených tvarech Kc = [H+][A-]/[HA] KT = aH+ · aA- / aHA Mezi oběma konstantami platí vztah V analytické chemii se pracuje s roztoky, které se nechovají jako ideální, proto je výhodnější používat k výpočtům pH koncentračních konstant. Hodnota této konstanty se mění v závislosti na iontové síle roztoku podle vztahu Hodnoty zlomku pro různou iontovou sílu a veličiny N jsou uvedeny v tabulce 9. | ||
| |||||

 H3O+ + A– jsou
konstanty definovány vztahy
H3O+ + A– jsou
konstanty definovány vztahy