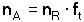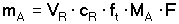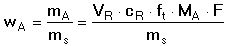| |||||
|
V odměrné analýze se zjišťuje obsah stanovované složky na základě spotřeby titračního činidla. Přitom je třeba si uvědomit, na jakém mechanismu je reakce založena. Chemické reakce probíhají tak, že látková množství spolu reagujících složek i produktů vznikajících reakcí jsou v poměru malých celých čísel. Např.:
Z příkladů je zřejmé, že na úplnou neutralizaci látkového množství 1 mol
H2SO4 je třeba množství 2 molů NaOH a látkové množství stanovované
kyseliny sírové ve vzorku je poloviční, než je látkové množství hydroxidu sodného:
n(H2SO4) = n(NaOH) · 1/2
a opačně: n(NaOH) = n(H2SO4) · 2
Podobné vztahy lze zaznamenat u dalších uvedených příkladů:
Číselný koeficient - v odměrné analýze nazývaný stechiometrický (titrační) faktor nebo faktor titrace ft - odvozený z vyčíslené chemické rovnice, umožňuje přepočet látkového množství jedné složky roztoku (titračního činidla, nR) na ekvivalentní látkové množství druhé (stanovované) složky nA: Příklady titračních přepočítavacích faktorů u různých typů reakcí:
K výpočtu obsahu stanovované složky je třeba znát spotřebu titračního činidla VR, jeho titr (přesnou látkovou koncentraci) cR, titrační faktor ft a molární hmotnost stanovované složky MA. Často se však titruje pouze určitá část celkového objemu vzorku. V tomto případě je třeba z titrace nalezené množství látky násobit příslušným koeficientem ředění F (F = Vcelk. / Vtitr.). Hmotnost stanovované složky mA se pak vypočítá ze vztahu v němž veličiny mají rozměr: mA ... [mg], VR ... [ml], cR ... [mmol·ml-1], MA ... [mg·mmol-1], resp. mA ... [g], VR ...[litr], cR ... [mol·l-1],
MA ... [g·mol-1].
Procentový (hmotnostní) obsah určované látky bude definován poměrem její hmotnosti k celkové hmotnosti vzorku
| ||||||||||||||||||||||||||||||||||||||||||
| |||||