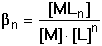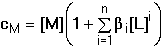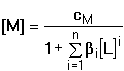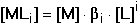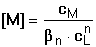| |||||
|
Komplexy mohou vznikat postupnou koordinací ligandu k centrálnímu kovovému iontu. Jednotlivé rovnováhy jsou charakterizovány dílčími (konsekutivními) konstantami stability: M + L
 ML
K1 = [ML][M]–1 [L]–1 ML
K1 = [ML][M]–1 [L]–1ML + L
 ML2
K2 = [ML2][ML]–1[L]–1 ML2
K2 = [ML2][ML]–1[L]–1MLn-1 + L
 MLn
Kn = [MLn][MLn-1]–1[L]–1 MLn
Kn = [MLn][MLn-1]–1[L]–1Součin dílčích konstant představuje celkovou konstantu stability: K1·K2·····Kn = βn Kovový ion je v roztoku rozdělen mezi všechny stupně komplexotvorné rovnováhy: cM = [M] + [ML] + [ML2] + ..... + [MLn]
= [M](1 + β1[L] + β2[L]2 + ......+
βn[L]n)
 Pro rovnovážnou koncentraci kovového iontu pak platí Výpočet koncentrace jednotlivých komplexů je možný ze základního definičního vztahu: Při velkém nadbytku ligandu je v roztoku prakticky jediný, a to nejvyšší komplex MLn, takže cM ≈ [MLn] a [L] ≈ cL. Vztah (12) lze tím upravit na tvar Řešené příklady:
| ||
| |||||