Řešení: Z poměru molárních hmotností vyplývá, že
 1 mol Fe2O3 1 mol Fe2O3a pro hmotnosti z toho plyne úměra
2 · 55,85 g Fe ........... 159,70 g Fe2O3
m g Fe ...................... 0,1825 g Fe2O3
m = 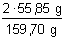 · 0,1825 g = 0,6994 · 0,1825 g = 0,1276 g Fe · 0,1825 g = 0,6994 · 0,1825 g = 0,1276 g Fe
n(Fe) = n(Fe2O3) · 2
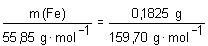 · 2 · 2  m(Fe) = 0,1276 g m(Fe) = 0,1276 g
Hmotnostní zlomek podle (5):
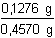 = 0,2792 ...... 27,92% = 0,2792 ...... 27,92%
Hmotnostní (procentový) obsah železa ve vzorku síranu železitého je 27,92%. | ||