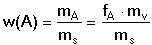|
Při vážkové analýze se vylučuje určovaná látka ve formě málo rozpustné
sloučeniny, která se po izolaci buď přímo váží (po vysušení), nebo se žíháním převádí na
sloučeninu známého a stálého složení, vhodnou k vážení. Z jejího množství se na základě
stechiometrie vypočítá obsah hledané složky v původním vzorku.
2.1. Použití přepočítavacích faktorů
Stechiometrický poměr molárních hmotností stanovované (určované) látky a
váženého chemického individua (vyvážky) je označován jako přepočítávací,
stechiometrický nebo gravimetrický faktor. Hodnoty běžných faktorů jsou uváděny
v chemicko-analytických tabulkách a laboratorních příručkách.
Obecně při stanovení látky A, kterou vážíme ve formě sloučeniny AjBp (vyvážka),
platí pro gravimetrický faktor vztah
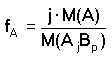 resp.
resp. 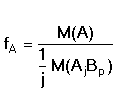 (1) (1)
Hmotnost hledané složky A pak vypočítáme pomocí faktoru a hmotnosti vyvážky mv:
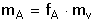 (2) (2)
K témuž vztahu lze dospět také na základě rovnosti látkových množství stanovované
složky a vyvážky:
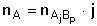 (3) (3)
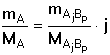
 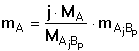 (4) (4)
Hmotnostní (procentový) obsah lze pak určit z poměru hmotností hledané složky a vzorku
(navážky):
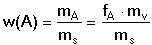 (5) (5)
Řešené příklady:
- Příklad 2.1

- Vytvořte vztahy pro výpočet gravimetrických faktorů:
a)
| hledaná složka | vyvážka | faktor
|
|---|
| Ag | Ag3AsO4 |
| | Na2O | NaCl |
| | Fe3O4 | Fe2O3 |
|
b) Vztahy pro faktor na základě reakčního schématu:
As → Na3AsO4 → Ag3AsO4 → AgCl
As2O3 → 2NH4MgAsO4 → 2NH4MgPO4 → Mg2P2O7
2Mg → 2NH4MgPO4 → P2O5·24MoO4
H2C4H4O6 → CaC4H4O6 → CaCO3 → CaCl2 → 2AgCl
- Příklad 2.2

- Vzorek bezvodého síranu železitého o hmotnosti 0,4570 g byl rozpuštěn ve
vodě, ionty železité byly vysráženy amoniakem jako Fe(OH)3 a po vyžíhání hydroxidu
bylo získáno 0,1825 g Fe2O3. Jaký je hmotnostní obsah železa ve vzorku
síranu železitého? Ar(Fe) = 55,85; Mr(Fe2O3) = 159,70.
- Příklad 2.3

- Z navážky 0,5872 g směsi Ag3AsO4 a NaNO3 bylo získáno
0,1081 g Mg2As2O7. Jaký je hmotnostní obsah stříbra ve
směsi? Ar(Ag) = 107,87; Mr(Mg2As2O7) = 310,45.
- Příklad 2.4

- Jaké množství stříbrné slitiny obsahující kolem 80%(m/m) stříbra je třeba
navážit, abychom pro přesné stanovení stříbra ve slitině získali 0,15 g AgCl jako
vyvážku? Ar(Ag) = 107,87; Mr(AgCl) = 143,34.
- Příklad 2.5

- Chlorid barnatý dihydrát o hmotnosti 0,5078 g byl opatrně zahříván, aby se
odstranila hydratovaná voda. Úbytek hmotnosti činil 0,0742 g. Jaký byl hmotnostní
obsah BaCl2·2H2O v původním vzorku?
- Příklad 2.6

- Jaká má být navážka látky obsahující měď, aby se stonásobná hmotnost
sulfidu měďného aritmeticky rovnala hmotnostní procentualitě mědi?
Ar(Cu) = 63,54; Mr(Cu2S) = 159,16.
|
|

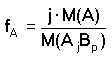
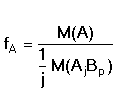 (1)
(1)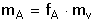
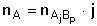
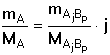

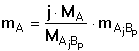 (4)
(4)