Řešení: Podle vztahu (59)
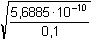 =
7,54·10-5 ..... 0,00754 % =
7,54·10-5 ..... 0,00754 %
Hodnota pH roztoku:
pH = –log (0,1 · 7,54·10–5) = 5,12
podle
(61)
pH = 1/2(9,245 – log 0,1) = 5,12
Výpočet pH je dostatečně správný, neboť pH > 1,30 – log cBH+ a
pOH > pH.
pKB,c = 4,755 – 0,24 = 4,515
pH = 1/2(13,76 – 4,515 – log 0,1) = 5,12
γ =
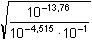 =
10–4,122 = 7,54·10–5 =
10–4,122 = 7,54·10–5Roztok dusičnanu amonného 0,1 molární je hydrolyzován na 0,00754 % a jeho pH je 5,12. Vzhledem k tomu, že konstanty pKw a pKB se vlivem iontové síly roztoku sníží o stejnou hodnotu, pH se nezmění. | ||