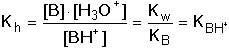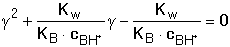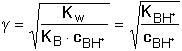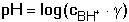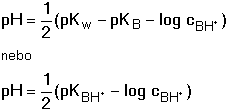| |||||
|
Kation slabé zásady je slabou kyselinou, podléhá tedy hydrolýze BH+ + H2O Konstanta hydrolýzy bude definována vztahem (57) Dosazením stupně hydrolýzy (γ = [B]/cBH+ = [H3O+]/cBH+) do vztahu (57) a úpravou se získají rovnice pro výpočet γ a pH roztoků: resp. pro γ « 1 Hodnoty pH získané na základě přibližného vztahu (61) lze upřesnit podle podmínek uvedených v kapitole 5.3.1. Řešené příklady:
| ||
| |||||

 B + H3O+
B + H3O+