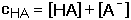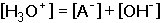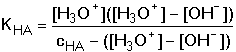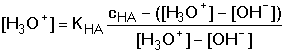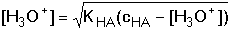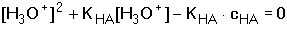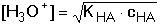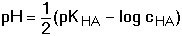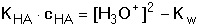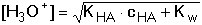|
5.3.1. Slabé jednosytné kyseliny
Odvození vztahů pro výpočet pH je umožněno třemi základními podmínkami: látkovou bilancí,
podmínkou elektroneutrality a disociační konstantou. Pro slabou kyselinu HA a její
konjugovanou zásadu A- tedy platí
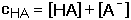 - látková bilance (25)
- látková bilance (25)
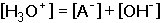 - podmínka elektroneutrality roztoku (26)
- podmínka elektroneutrality roztoku (26)
Dosazením (26) a (25) do
(21)
a úpravou lze získat obecný vztah pro [H3O+]
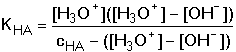 (27) (27)
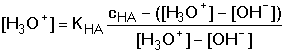 (28) (28)
Protože obvykle platí [H+] > [OH–], výraz (28) se zjednoduší na tvar
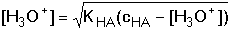 (29) (29)
resp.
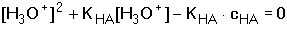 (30) (30)
Pokud platí cHA > [H3O+], tzn. [HA] ≈ cHA,
výraz (28) resp. (29) se dále zjednoduší
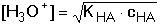 (31a) (31a)
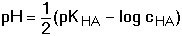 (31b) (31b)
V roztocích téměř neutrálních platí cHA > ([H3O+] –
[OH-]) a rovnice (27) přejde na tvar
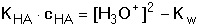
a odtud
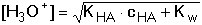 (32) (32)
Postup při výpočtu (tolerance chyby 5%):
- Nejdříve se pH počítá podle vztahu (31). Je-li koncentrace H3O+-iontů
menší než 5% koncentrace kyseliny, tj. [H3O+] ≤ 0,05cHA,
resp. pH ≥ 1,30 – log cHA a také [OH-] ≤
0,05[H3O+] (tj. pOH ≥ 1,30 + pH), výpočet je dostatečně správný.
- Je-li koncentrace H3O+-iontů větší než 5% koncentrace kyseliny, tj.
[H3O+] ≥ 0,05cHA, resp. pH ≤ 1,30 – log cHA,
je třeba výpočet upřesnit řešením kvadratické rovnice (30) - použijeme pouze kladný kořen.
Lze však použít i aproximace podle (29), kde se v prvém kroku dosadí za [H3O+]
pod odmocninou hodnota ze vztahu (31).
- Je-li ([H3O+] - [OH-]) < 0,05cHA a roztok
má téměř neutrální reakci, postupujeme podle (32).
- Je-li iontová síla I > 0,001 (např. vlivem neutrálních solí), je třeba počítat
s disociační konstantou koncentrační Kc.
|
|