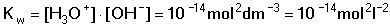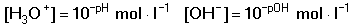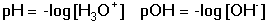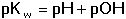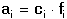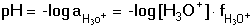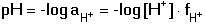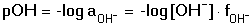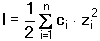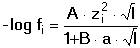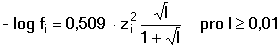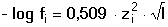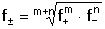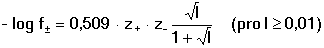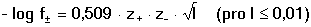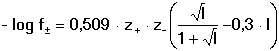| |||||
|
Protolyt je sloučenina, která ve vhodném rozpouštědle je schopná odštěpit (kyselina) nebo vázat (zásada) proton. Dva protolyty, lišící se pouze o jeden proton, tvoří konjugovaný pár (např. CH3COOH a CH3COO–). Kyselina (HA) a zásada (B) dvou rozdílných párů spolu reagují za vzniku konjugované zásady (A) a kyseliny (HB). Reakce se nazývá protolýza:
Vzniká-li ze dvou molekul téže sloučeniny kyselina a zásada podle schématu 2 HS jedná se o autoprotolýzu. Voda je nejběžnějším amfiprotním rozpouštědlem. Může tedy přijímat i odštěpit proton, kromě toho podléhá autoprotolýze: 2 H2O Rovnováha je definována iontovým součinem (produktem) vody Kw, který současně určuje aciditní rozsah vodného prostředí Koncentrace hydroxoniových a hydroxidových iontů v roztoku se vyjadřuje exponentem pH nebo pOH a pH či pOH lze definovat jako Záporný logaritmus iontového produktu vody bude pak vyjádřen V reálných roztocích však dochází k vzájemnému ovlivňování složek systému. Jejich účinnost pak nelze vyjadřovat koncentrací jako u roztoků ideálních (nekonečně zředěných), nýbrž aktivitou. Vzájemný vztah aktivity a koncentrace určuje aktivitní koeficient Exponent pH resp. pOH pak bude formulován resp. zjednodušeně Hodnota aktivitního koeficientu se mění s iontovou silou I roztoku a lze jej vypočítat na základě Debye-Hückelovy rovnice Konstanty A,B zahrnují vliv teploty a relativní permitivity prostředí, parametr a je střední hodnota průměru iontu. Ve vodném prostředí při 25°C konstanta A má hodnotu 0,509, pro malé ionty součin B·a ≈ 1 a rovnice se zjednoduší na tvar Ve zředěnějších roztocích (I ≤ 0,01) není třeba přihlížet k objemu iontu a lze používat zjednodušenou rovnici U roztoků velmi zředěných, u nichž iontová síla I < 0,001, lze očekávat chování téměř jako u roztoků ideálních. Experimentálně nelze aktivitní koeficienty jednotlivých iontů zjistit, změřit je možné střední aktivitní koeficient f± sloučeniny. Ten je geometrickým průměrem koeficientů iontů (disociuje-li elektrolyt na m kationtů a n aniontů). Jeho hodnotu lze rovněž vypočítat na základě iontové síly roztoku resp.K výpočtu aktivitních koeficientů je v některých případech doporučován přesnější Daviesův vztah Pro uni-univalentní elektrolyty odchylka vypočtených a experimentálně nalezených hodnot obvykle není větší než ±3%. U elektrolytů s vícevalentními ionty mohou vypočtené hodnoty koeficientů nabývat značně odlišných údajů vlivem zanedbání rozdílné velikosti hydratovaných iontů. Proto u roztoků chemických individuí upřednostňujeme při výpočtech experimentálně zjištěné hodnoty koeficientů, které pro různé sloučeniny jsou tabelovány v různých příručkách (viz tab.7). | ||
| |||||

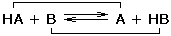
 H2S+ + S–
H2S+ + S–