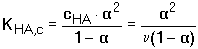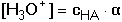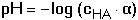|
5.3.1. Slabé jednosytné kyseliny (pokračování)
K výpočtu pH roztoků slabých kyselin lze také použít disociačního stupně α
(obvykle je udáván v procentech) - vyjadřuje poměr koncentrace disociované složky
k celkové koncentraci kyseliny. Protože
[H3O+] = [A-] = cHA · α
a [HA] = (1–α) · cHA
lze koncentrační disociační konstantu napsat ve tvaru
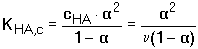 (33) (33)
kde ν = 1/cHA, což je stupeň zředění (základní rozměr [l·mol-1],
resp. [dm3·mol-1]).
Výpočet koncentrace H3O+-iontů, resp. pH lze uskutečnit ze vztahu
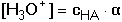 resp.
resp.
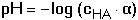 (34) (34)
Řešené příklady:
- Příklad 5.38

- Kyselina mravenčí je v 0,75%(m/m) roztoku (ρ = 1,000 g·cm-3)
disociována na 3,53%. Jakou hodnotu má disociační konstanta kyseliny a jaké je pH tohoto roztoku?
Mr(HCOOH) = 46,03.
- Příklad 5.39

- Jaká je disociační konstanta kyseliny octové, je-li rozpuštěno látkové množství 1 mol
kyseliny v objemu 14,3 litrů vody a je-li při této koncentraci kyselina disociována na 1,57 %?
- Příklad 5.40

- Disociační konstanta kyseliny mravenčí je 2,10·10–4. Jaký je stupeň
disociace a pH roztoku s hmotnostním obsahem 1,5% (m/m) HCOOH. Mr(HCOOH) = 46,03.
- Příklad 5.41

- Jaké pH má 0,001 molární roztok kyseliny mravenčí? pKHA = 3,68.
- Příklad 5.42

- Vypočtěte pH 1·10–4 molárního roztoku kyseliny borité!
pKHA = 9,24.
- Příklad 5.43

- K množství 2,00 g krystalického octanu sodného bylo přidáno 7,35 ml kyseliny sírové
(c = 1 mol·l–1) a směs byla zředěna vodou na objem 250 ml. Jaké je pH
vzniklého roztoku? pK(CH3COOH) = 4,756;
Mr(CH3COONa·3H2O) = 136,08.
|
|