Řešení: V 1 litru roztoku je 7,5 g HCOOH, tj. 0,1629 mol·l-1. Disociační stupeň: α = 0,0353
Výpočet konstanty podle (21) a (33): a) KHA =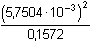 =
2,10·10–4 =
10–3,68 =
2,10·10–4 =
10–3,68
b) KHA =
a) pH = –log (0,1629 · 0,0353) = –log 5,7504·10–3 =
2,24
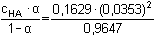 =
2,10·10–4 =
10–3,68 =
2,10·10–4 =
10–3,68b) pH = 1/2(3,68 - log 0,1629) = 1/2 · 4,468 = 2,23
Ověření správnosti výpočtu pH: 1,30 – log cHA = 1,30 + 0,79 = 2,09 < pH = 2,231,30 + pH = 3,53 < pOH = 11,77
Vypočtená hodnota pH podle
(31b):
je dostatečně správná.
Kyselina mravenčí má disociační konstantu KHA = 2,10·10–4 (pKHA = 3,68) a 0,75% roztok kyseliny má pH 2,23. | ||