Řešení: Kyselina sírová vytěsní z octanu ekvivalentní množství kyseliny octové. Reakcí tedy vzniklo 14,7 mmol kyseliny octové a 7,35 mmol síranu sodného. Koncentrace kyseliny
octové: Podle (31b): pH = 1/2(4,756 – log 0,0588) = 2,99 Na hodnotu konstanty má vliv velká iontová síla roztoku, způsobená síranem sodným (podíl disociace kyseliny octové na iontovou sílu roztoku je zanedbatelný).
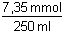 =
0,0294 mmol·ml-1 = mol·l-1 =
0,0294 mmol·ml-1 = mol·l-1
I = 0,5(0,0588·12 + 0,0294·22) = 0,0882
Podle
(24) a
(31b):
pKc = 4,756 –
Protože je splněna podmínka a), výsledek je správný. Roztok má pH 2,88. | ||
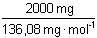 = 14,7 mmol octanu sodného a 7,35 · 1 mmol
H2SO4, tj. 14,7 mmol H3O+-iontů
= 14,7 mmol octanu sodného a 7,35 · 1 mmol
H2SO4, tj. 14,7 mmol H3O+-iontů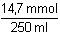 = 5,88·10–2
mmol·ml-1 = mol·l-1
= 5,88·10–2
mmol·ml-1 = mol·l-1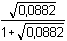 = 4,756 – 0,229 = 4,527
= 4,756 – 0,229 = 4,527