|
- Příklad 5.42
- Vypočtěte pH 1·10–4 molárního roztoku kyseliny borité!
pKHA = 9,24.
Řešení:
Podle
(31b):
pH = 1/2(9,24 – log 10–4) = 6,62 [H3O+] =
2,40·10–7 mol·l-1
pOH = pKw – pH = 7,38 [OH -] = 4,17·10 –8
mol·l -1
Roztok je téměř neutrální, rozdíl ([H3O+] – [OH-]) =
1,983·10-7 mol·l-1 < 0,05cHA. Tím je splněna
podmínka c) a pH vypočítáme podle vztahu
(32).
[H 3O +] = 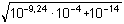 = 2,599·10 –7 mol·l -1 =
10-6,58 mol·l-1
Roztok kyseliny borité má pH 6,58.
Zpět
| | |
| |