Řešení: celková koncentrace kyseliny cHCOOH = 15/46,03 = 0,3259 mol·l-1 a) Z definičního vztahu pro konstantu (21) a rovnice (25) vyplývá, že [H3O+] = [HCOO–]a [HCOOH] = cHCOOH – [H3O+] = (0,3259 –
[H3O+]) mol·l-1
2,10·10-4 = 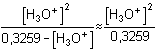
Z této rovnice je koncentrace hydroxoniového iontu: [H3O+] = 8,273·10-3 mol·l-1 a stupeň disociace α =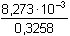 = 0,0254 .....
2,54 % = 0,0254 .....
2,54 %
b) Úpravou vztahu (33) se získá kvadratická rovnice cHA·a2 + KHA · α - KHA = 0jejíž kladný kořen α = 0,0251 ..... 2,51 %
Výpočet pH: a) podle (34): pH = –log (0,3258 · 0,0254) = 2,08b) podle
(31b):
pH = 1/2 (3,68 – log 0,3258) = 2,08
Kontrola správnosti: pH = 2,08 > 1,30 – log 0,3258 = 1,79 Stupeň disociace 1,5%(m/m) roztoku kyseliny mravenčí je 0,0254 (kyselina je disociována na 2,54%) a pH roztoku je 2,08 (hodnota je dostatečně správná). | ||