Řešení: V důsledku hydrolýzy se v roztoku ustaví 2. a 3. protolytická rovnováha H2A- Přibližný výpočet pH podle (73a):
Správnější výpočet bude podle (70), neboť součin K2 · [HA2-] = 9,57·10-16 a hodnota Kw je tedy významná:
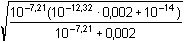 =
5,812·10-10 mol·l-1 =
5,812·10-10 mol·l-1
pH = 9,24
Podmínka (71) je splněna, výpočet je dostatečně správný. Vliv iontové síly roztoku (I = 0,006):
pK3,c = 12,32 – 3 · 0,072 = 12,10
Hodnoty pH podle (73) a podle (70) jsou 9,59 a 9,15. Správné hodnoty pH 0,002 molárního roztoku hydrogenfosforečnanu sodného jsou 9,24 (9,15). | ||
 HA2-
HA2-  A3-
A3-