Řešení: a) Pro výpočet koncentrace je třeba zjistit celkový objem (V1 + V2) po přídavku hydroxidu. Spotřeba V2 (ml) NaOH na částečnou neutralizaci:
 V2 = 0,15 · V1 ml V2 = 0,15 · V1 ml
Celkový objem směsi bude: V = V1 + V2 = 1,15 · V1 ml Koncentrace mravenčanu:
Koncentrace zbývající kyseliny mravenčí:
Hodnota pH roztoku podle (76):
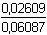 = 3,752 – 0,368 = 3,384
≈ 3,38 = 3,752 – 0,368 = 3,384
≈ 3,38
b) Ke stejnému výsledku lze dospět, jestliže se místo látkových koncentrací složek dosadí jejich procentový obsah:
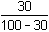 = 3,752 – 0,368 = 3,384
≈ 3,38 = 3,752 – 0,368 = 3,384
≈ 3,38
c) Upřesnění výsledku korekcí na iontovou sílu roztoku (I = 0,026):
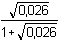 ) – 0,368 = 3,613 – 0,368 =
3,24 ) – 0,368 = 3,613 – 0,368 =
3,24
Roztok mravenčanového pufru má pH 3,38 (3,24). | ||