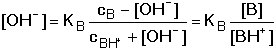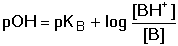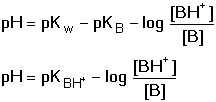| |||||
|
Roztoky vzniklé smícháním slabé kyseliny a její konjugované zásady (resp. slabé zásady a konjugované kyseliny) nebo částečnou neutralizací slabé kyseliny (resp. slabé zásady) označujeme jako roztoky tlumivé (pufry). V roztoku směsi jednosytné slabé kyseliny a příslušné konjugované zásady se ustavují následující rovnováhy: HA + H2O
 H3O+ + A-
H3O+ + A-A- + H2O
 HA + OH-
HA + OH-Při zanedbání disociace vody platí pro rovnovážné koncentrace konjugovaných složek HA a A– vztahy odvozené z celkových analytických koncentrací: [HA] = cHA – [H3O+] + [OH–] [A–] = cA- – [OH–] + [H3O+] Po dosazení těchto rovnic do disociační konstanty kyseliny a úpravě se získá obecně platná Henderson-Hasselbachova rovnice pro výpočet pH tlumivého roztoku Pokud KHA » 10–7 (pH « 7), je [H3O+] » [OH–], lze tedy koncentraci hydroxidových iontů zanedbat a vztah přejde na tvar Koncentrace solvatovaného protonu pak představuje kladný kořen kvadratické rovnice. Hodnotu pH lze také vypočítat z logaritmického tvaru rovnice (75a) Pokud platí 0,05cA ≥ [H3O+] ≤ 0,05cHA a současně 0,05cA ≥ [OH–] ≤ 0,05cHA, rovnovážné koncentrace [H3O+] a [OH–] jsou zanedbatelné vůči cHA a cA a rovnice (75) přechází na jednoduchý tvar, vhodný k výpočtu přibližné hodnoty pH tlumiče. Hodnoty pH lze upřesnit korekcí disociačních konstant na iontovou sílu roztoku. Pro výpočet pH tlumivých roztoků, vytvořených od vícesytných slabých kyselin, lze použít vztahu (75), resp. (75a) s tím rozdílem, že je třeba uvažovat disociační rovnováhu určitého stupně. Obdobné vztahy lze odvodit pro pH tlumivých roztoků tvořených směsí slabé zásady a konjugované kyseliny: B + H2O
 BH+ + OH-
BH+ + OH-BH+ + H2O
 B + H3O+
B + H3O+[B] = cB – [OH–] + [H3O+] [BH+] = cBH+ - [H3O+] + [OH–] Protože KB > 10–7 (pKB < 7), bude [OH–] » [H3O+] a lze tedy koncentraci H3O+-iontu zanedbat. Koncentrace [OH–] je kladným kořenem kvadratické rovnice. Hodnotu pOH lze také vypočítat z logaritmického tvaru pravé části rovnice Pro pH pak bude platit vztah Je-li koncentrace OH–-iontů zanedbatelná vůči celkové analytické koncentraci protolytů cBH+ a cB, tj. 0,05·cBH+ ≥ [OH–] ≤ 0,05· cB, lze rovnovážné koncentrace nahradit celkovými. Získáme tak vztah pro přibližný výpočet pH alkalického tlumiče. Řešené příklady:
| ||
| |||||

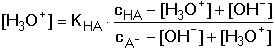
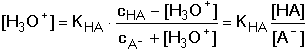
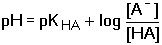
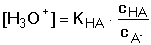
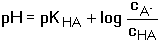 (76a)
(76a)