Řešení: Tetraboritan ve vodě hydrolyzuje podle rovnice B4O72- + 5 H2O
Koncentrace složek po přídavku kyseliny chlorovodíkové budou následující:
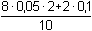 =
0,10 mmol·ml-1 = mol·l-1 =
0,10 mmol·ml-1 = mol·l-1
[H2BO3-] =
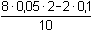 =
0,06 mmol·ml-1 = mol·l-1 =
0,06 mmol·ml-1 = mol·l-1Hodnota pH roztoku podle (76) bude:
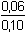 = 9,24 – 0,22 =
9,02 = 9,24 – 0,22 =
9,02
Při korekci na iontovou sílu roztoku uvažujeme látkovou koncentraci boritanu a chloridu sodného (I = 0,08):
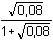 ) +
log ) +
log 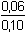 = (9,24 – 0,22) – 0,22 =
8,80 = (9,24 – 0,22) – 0,22 =
8,80
Boraxový tlumivý roztok má pH 9,02 (8,80). | ||
 2 H3BO3 +
2 H2BO3-
2 H3BO3 +
2 H2BO3-