Řešení: Z původní hodnoty pH je nutno vypočítat disociační konstantu a pomocí této veličiny pak stupeň neutralizace:
KHA =
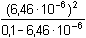 =
4,17·10–10 =
4,17·10–10Stupeň neutralizace: pH 9,95 ...... [H3O+] = 1,12·10–10 mol·l-1
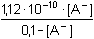
 [A-] = 0,07883 mol·l-1 [A-] = 0,07883 mol·l-1
Kyselina, původně 0,1 molární, je zneutralizována na 78,83 %. | ||