Řešení: Výpočet koncentrace iontu v přebytku po neutralizační reakci: a) b)70 · 0,20 = 14,0 mmol KOH
70·0,20 – 30·0,15 = 100·cOH-
30 · 0,15 = 4,5 mmol HCl
přebytek 9,5 mmol KOH cOH- = Iontovou sílu roztoku tvoří ionty: K+, Cl– a OH–:
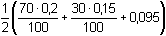 = 0,1407 ≈ 0,14 = 0,1407 ≈ 0,14
 fOH- = 0,727 fOH- = 0,727
aOH- = 0,095 · 0,727 = 0,0691 mol·l-1 =
10-1,161 mol·l-1
pOH = 1,61 pH = (14 – 0,27) – 1,61 = 12,57
Roztok má pH 12,57, vliv iontové síly roztoku na aciditu je značný. | ||
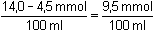 = 0,095 mol·l-1
= 0,095 mol·l-1