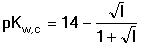|
5.2.2. Silné zásady
Výpočet koncentrace (aktivity) OH–-iontů, resp. pOH je analogický jako v případě
koncentrace (aktivity) H3O+-iontů, resp. pH. K přepočtu na koncentraci
hydroxoniových iontů nebo pH použijeme vztahů
(1) nebo
(3).
Má-li se výpočet přiblížit naměřené hodnotě pH reálných roztoků, je třeba použít hodnotu iontového
produktu vody Kw,c platnou pro určitou iontovou sílu roztoku
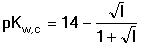 (20) (20)
Řešené příklady:
- Příklad 5.24

- Vypočtěte pH roztoků a) 0,02M-KOH, b) 4·10–4M-Ba(OH)2!
- Příklad 5.25

- Jaké pH má roztok vzniklý ředěním 10 ml 0,25M-KOH vodou na 200 ml?
- Příklad 5.26

- Vypočtěte pH roztoku, který vznikne smícháním 30 ml 0,15M-HCl a 70 ml 0,20M-KOH!
|
|