Řešení: Látkovou koncentraci vypočítáme ze vztahu (36) s konstantou bazicity KB:
10,50 = 14 – 1/2(4,755 – log cB)
cB = cNH3 = 10–2,245 mol·l-1 =
5,69·10–3 mol·l-1
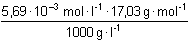 =
9,69·10–5 ..... 0,00969 % =
9,69·10–5 ..... 0,00969 %
Hmotnostní obsah amoniaku v roztoku hydroxidu amonného je 0,00969 %. | ||