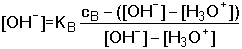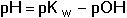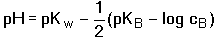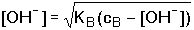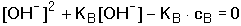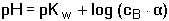|
5.3.2. Slabé jednosytné zásady
Postup odvození vztahů pro výpočet pOH roztoků slabých zásad a způsob použití je zcela obdobný
jako v případě pH, resp. [H3O+] slabých jednosytných kyselin. Obecný vztah
pro koncentraci OH- má tvar
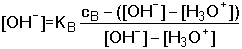 (35) (35)
Disociační (aktivitní) konstanta zásady je definována
KB = aB · aOH- /
aBOH
a lze ji zjistit ze vztahu:
pKBH+ + pKB = pKw
Disociační konstanty konjugovaných (kationtových) kyselin pKBH+ jsou
uvedeny v chemických tabulkách (viz tab. 8).
Při výpočtu pH roztoků slabých zásad zjistíme nejprve přibližnou hodnotu pH, resp. pOH podle vztahu (36)
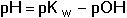

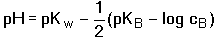 (36) (36)
kterou pak dále zpřesňujeme s tolerancí 5%:
- Je-li pOH ≥ 1,30 – log cB a pH > 1,30 + pOH, vypočtená hodnota je správná.
- Je-li pOH ≤ 1,30 – log cB, výpočet je třeba upřesnit buď postupnou aproximací
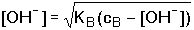 (37a) (37a)
nebo výpočtem pomocí kvadratické rovnice
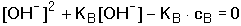 (37b) (37b)
- Je-li ([OH-] – [H3O+]) < 0,05cB a roztok
má přibližně neutrální reakci, počítáme podle vztahu
 (38) (38)
- Je-li iontová síla roztoku I > 0,001, počítáme s koncentračními konstantami KB
a Kw.
K výpočtu pH lze také použít disociačního stupně α, neboť [OH-] = cB
· α, tedy
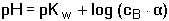 (39) (39)
Řešené příklady:
- Příklad 5.61

- Jaká je hodnota pH 0,2 molárního roztoku hydroxidu amonného, který je disociován na 0,955 %?
- Příklad 5.62

- Jaký hmotnostní obsah amoniaku má roztok hydroxidu amonného o pH 10,50?
pK(BH+) = 9,245; Mr(NH3) = 17,03.
- Příklad 5.63

- K objemu 30 ml 0,5M-NH4Cl bylo přidáno 150 ml 0,1 molárního roztoku KOH.
Jaké je pH výsledné směsi? pK(BH+) = 9,245.
|
|