Řešení: Roztok obsahuje: 30 · 0,5 = 15 mmol NH4Cl
150 · 0,1 = 15 mmol KOH
Reakcí vznikne 15 milimolů NH4OH a 15 milimolů KCl.
Látková koncentrace hydroxidu amonného: cNH4Cl = 15/180 =
0,0833 mol·l-1
Podle (36): pH = 14 - 1/2(4,755 – log 0,0833) = 11,08 Vypočtená hodnota vyhovuje podmínce správnosti a), avšak vlivem chloridu draselného je v roztoku značná iontová síla (I = 0,0833). Je tedy třeba počítat s koncentračními konstantami. Podle (24):
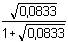 = 14 – 0,224 = 13,776 = 14 – 0,224 = 13,776
pKB,c = 4,755 – 0,224 = 4,531 nebo
pKB,c = pKw,c – pKBH+ = 13,776 – 9,245 = 4,531
Výsledné pH roztoku směsi je 10,97. | ||