Řešení: 1 ml kyseliny obsahuje 0,96 · 1,8355 = 1,7621 g H2SO4, zředěním na 1 litr bude vzniklý roztok 0,01796 molární. Iontová síla roztoku:
Střední aktivitní koeficient
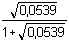 = 0,1918 f±
= 0,643 = 0,1918 f±
= 0,643
Aktivita H3O+-iontů:
Připravený roztok kyseliny sírové bude mít pH 1,64 (pro f± = 0,472, zjištěný z grafické závislosti tabelovaných hodnot f± na koncentraci kyseliny, pH roztoku je 1,77). | ||