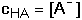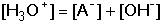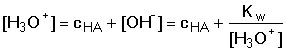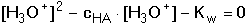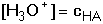|
5.2. Výpočet pH silných protolytů
5.2.1. Silné kyseliny
Protolytická rovnováha silných jednosytných kyselin ve vodě
HA + H2O  A– + H3O+ A– + H3O+
je výrazně posunuta doprava, takže nedisociované molekuly se ve vodném prostředí prakticky
nevyskytují ([HA] ≈ 0). Z látkové bilance pak plyne
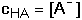 (15) (15)
Na základě podmínky elektroneutrality roztoku
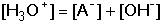 (16) (16)
a s využitím rovnice (15) lze odvodit vztah pro výpočet koncentrace H3O+-iontu
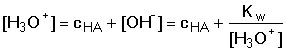 (17) (17)
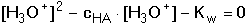 (18) (18)
Je-li člen [OH–] v rovnici (17) zanedbatelný vůči celkové koncentraci cHA
silné kyseliny, lze vztah zjednodušit na tvar
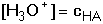 (19) (19)
Použitelnost uvedených vztahů:
- Podle vztahu (19) lze počítat koncentraci H3O+-iontu (resp. pH)
v rozmezí koncentrací kyselin 1·10–3 > cHA >
5·10-7 mol·l-1.
- V roztocích o koncentraci silné jednosytné kyseliny cHA >
1.10–3 mol·l-1 (resp. iontové síle roztoku I > 0,001) je třeba
uvažovat aktivitu iontů.
- Je-li cHA < 5·10–7 mol·l-1, uplatní
se výrazně H3O+-ionty vzniklé disociací vody. K výpočtu se použije
kvadratická rovnice (18).
Řešené příklady:
- Příklad 5.4

- Jaké je pH roztoku 0,2M-HCl?
- Příklad 5.5

- Jaké je pH 0,02 molárního roztoku kyseliny sírové?
- Příklad 5.6

- Jaké je pH 1·10–8 molárního roztoku kyseliny chlorovodíkové?
- Příklad 5.7

- Jaké bude pH roztoku, jestliže 1 ml koncentrované kyseliny sírové (96% m/m,
ρ = 1,8355 g·cm-3) zředíme vodou na objem 1 litru? Mr = 98,08.
- Příklad 5.8

- Na jaký objem je třeba zředit 1 ml kyseliny chlorovodíkové s obsahem 0,75% (m/m) HCl
(ρ ≈ 1,000
g·cm-3), abychom získali roztok o pH 4,0 ?
Mr(HCl) = 36,46.
- Příklad 5.9

- Bylo smícháno 500 ml 0,05M-HCl a 100 ml 0,1M-NaOH. Jaké je pH vzniklého roztoku, uvažujeme-li
jednak koncentraci a jednak aktivitu H3O+-iontů?
|
|

 A– + H3O+
A– + H3O+