|
- Příklad 5.5
- Jaké je pH 0,02 molárního roztoku kyseliny sírové?
Řešení:
Koncentrace hydroxoniových iontů je dvojnásobná oproti koncentraci kyseliny:
[H3O+] = 2 cH2SO4 = 2 · 0,02 =
0,04 mol·l-1
a) Střední aktivitní koeficient kyseliny (tab. 7):
f± = 0,453
aH3O+ = 0,04 · 0,453 = 0,01812
mol·l-1 pH = 1,74
b) Výpočet přibližné hodnoty f± podle
(7) a
(12)
I = 0,5 (0,004·12 + 0,02·22) = 0,06
-log f ± = 0,509 · 1 · 2 ·
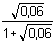 = 0,2003 f ±
= 0,630
Roztok kyseliny má pH 1,74 (1,60).
Zpět
|
|
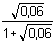 = 0,2003 f±
= 0,630
= 0,2003 f±
= 0,630