Řešení: Podle rozšířené zřeďovací rovnice (kap.1) zjistíme koncentraci HCl v přebytku (roztoky jsou tak zředěné, že změnu objemu v důsledku reakce neuvažujeme): 500 · 0,05 - 100 · 0,1 = 600 · cHCl
cHCl = 0,025 mol·l-1 pHc =
1,60
Iontová síla roztoku:
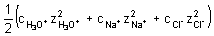
I = 0,5(0,025 + 0,017 + 0,042) = 0,042
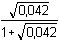 = 0,509 · 0,170 = 0,0866 = 0,509 · 0,170 = 0,0866
fH3O+ = 0,819
Roztok reakční směsi kyseliny a hydroxidu má pHc = 1,60 a pHa = 1,69.
|
| |