Řešení: Podle vztahu (41)
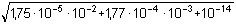
[H3O+] =
pH = 3,23
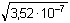 =
5,933·10–4 mol·l-1 =
10–3,227 mol·l-1 =
5,933·10–4 mol·l-1 =
10–3,227 mol·l-1K přesnějšímu výsledku dojdeme postupnou aproximací podle vztahu (40):
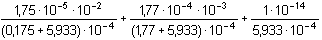
[H3O+] = 2,865·10–4 + 2,30·10–4 +
1,685·10–11 = 5,165·10–4 mol·l-1
pH = 3,287 ≈ 3,29
Další aproximace poskytují hodnoty: 3,23; 3,27; 3,24 Roztok směsi má pH 3,24. Protože KI < [H3O+] > KII, výpočet aproximací (40) nebyl nezbytný. | ||