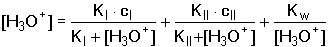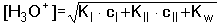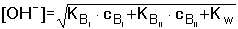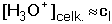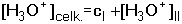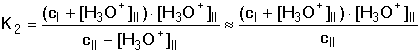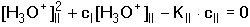| |||||
|
5.3.3. Směs jednosytných kyselin nebo zásad Při odvozování vztahů pro výpočet pH směsi dvou kyselin HAI a HAII vycházíme z disociačních konstant, látkové bilance a podmínky elektroneutrality: KI = [H3O+][AI-]/[HAI] KII = [H3O+][AII-]/[HAII] cI = [HAI] + [AI-] cII = [HAII] + [AII-] [H3O+] = [AI-] + [AII-] + [OH-] Je-li KI < [H3O+] > KII, výraz se zjednoduší na tvar Pro směs dvou slabých zásad platí obdobný vztahVýpočet [H3O+] nebo [OH-] se běžně provádí podle vztahů (41) nebo (42). Přesnější hodnota se získá aproximací ze vztahu (40) nebo z obdobné rovnice pro [OH-] - v prvním kroku se do jmenovatele v rovnici (40) dosadí přibližná hodnota [H3O+] z (41). V případě velké iontové síly roztoku používáme koncentračních disociačních konstant Kc. V případě směsi silné a slabé jednosytné kyseliny (cI a cII) se předpokládá potlačení disociace slabé kyseliny a pak pro přibližný výpočet pH platí Není-li podíl disociace slabé kyseliny zanedbatelný, tj. 0,05cI < [H3O+] > 0,05cII, pak Koncentrace [H3O+]II se vypočítá z disociační konstanty slabé kyseliny
Řešené příklady:
| ||
| |||||