Řešení: Ionty C2042- vzniklé disociací sloučeniny jsou dvojsytnou zásadou:
 +
HC204- + OH- +
HC204- + OH-
KB1 =
HC204- + H2O 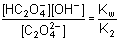 pKB1 = pKw – pK2 = 9,715
pKB1 = pKw – pK2 = 9,715 +
H2C204 + OH- +
H2C204 + OH-
KB2 =
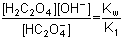 pKB2 = pKw – pK1 = 12,75
pKB2 = pKw – pK1 = 12,75a) Výpočet podle (45):
5,86 > 1,30 – log 0,01
pKB2 > 1,30 + pOH  výpočet je
dostatečně správný výpočet je
dostatečně správný výsledek není třeba
korigovat podle
(46)
ani
(47). výsledek není třeba
korigovat podle
(46)
ani
(47).
b) Vliv iontové síly roztoku:
pKw,c = 14 – 0,148 = 13,852
pK2,c = 4,285 – 2·0,148 = 3,989
pKB1,c = 13,852 – 3,989 = 9,863
pOH = 1/2(9,863 – log 0,01) = 5,93
pH = 13,85 – 5,93 = 7,92
Roztok štavelanu sodného má 7,92 (resp. 8,14). | ||