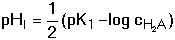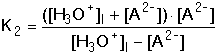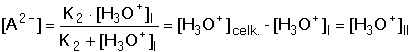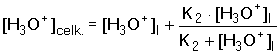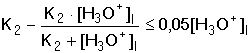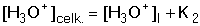| |||||
|
5.3.4. Vícesytné slabé kyseliny a zásady Disociační rovnováhy vícesytných kyselin a zásad jsou charakterizovány příslušnými konstantami K1 až Kn. U analyticky významných protolytů je první konstanta mnohonásobně větší než následující, a tedy první disociační rovnováha bude mít rozhodující vliv na aciditu roztoku. V prvém kroku vypočítáme přibližnou hodnotu pHI dvojsytné kyseliny podle již známého vztahu kterou zpřesňujeme podle podmínek b) až d) v kap. 5.3.1. Je-li pK2 > pHI + 1,30 (tj. pK2 > pHI – log cH2A), druhá disociační rovnováha je nevýznamná a hodnotu pH neovlivňuje. Je-li však pK2 < pHI + 1,30, příp. je-li (pK2 – pK1) ≤ 1,5, je nezbytné hodnotu pHI upřesnit přičtením koncentrace hydroxoniových iontů z disociace kyseliny do 2.stupně. [H3O+]celk. = [H3O+]I + [H3O+]II Dosazením [H3O+]II = [A2-] a [HA–] = [H3O+]I - [A2-] do konstanty K2
se obdrží kvadratická rovnice [A2-]2 + (K2 + [H3O+]I)[A2-] – K2·[H3O+]I = 0 Protože u slabé kyseliny je [A2-] ≈ 0, lze kvadratický člen zanedbat
Zcela analogicky se postupuje při výpočtu koncentrace OH–-iontů, resp. pOH, v roztocích vícesytných slabých zásad. V těchto případech ve vztazích figurují příslušné konstanty bazicity KB. Řešené příklady:
| ||
| |||||