Řešení: Přibližný výpočet pH podle (45):
Po upřesnění: [H3O+]I = 6,18·10–3
mol·l-1 Hodnota konstanty pK2 < pHI + 1,30, výpočet je třeba uskutečnit podle (46):
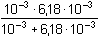 = 7,041·10–3
mol·l-1 = 7,041·10–3
mol·l-1
pH = 2,15
Splněna je také podmínka, že K2 < [H3O+]I, ovšem rozdíl je nevelký, takže podle (47) bude koncentrace H3O+ poněkud vyšší: [H3O+]celk. = 6,18·10–3 + 1·10–3 = 7,18·10–3 mol·l-1 pH = 2,14 Výsledné pH roztoku dvojsytné kyseliny je 2,14. | ||
 pHI = 2,21
pHI = 2,21