Řešení: Uvažujeme první hydrolytickou rovnováhu (druhá je zanedbatelná)
 HCO3- + OH-
HCO3- + OH-
Podle vztahu (53)
 = 0,0462
..... 4,62 % = 0,0462
..... 4,62 %
pH = 1/2(14 + 10,329 + log 0,1) = 11,66
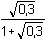 = 14 – 0,354 = 13,646 = 14 – 0,354 = 13,646
pK2,c = 10,329 – 2·0,354 = 9,621
γ = 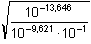 = 0,0307
..... 3,07 % = 0,0307
..... 3,07 %
pH = 13,646 + log (0,1 · 0,0307) = 11,13
pH = 1/2(13,646 + 9,621 + log 0,1) = 11,13
Uhličitan sodný hydrolyzuje na 4,62 % (3,07 %) a pH 0,1 molárního roztoku je 11,66 (11,13). | ||