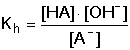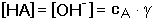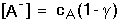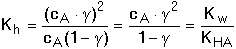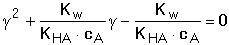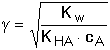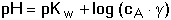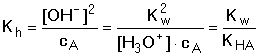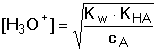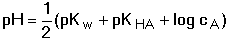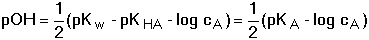| |||||
|
5.4. Výpočet pH hydrolyzovatelných iontů 5.4.1. Anionty slabých kyselin Soli slabých kyselin a silných zásad se ve vodném prostředí chovají jako silné elektrolyty, které prakticky úplně disociují na ionty. Anion slabé kyseliny pak podléhá hydrolýze
 M+ + A– M+ + A–
A– + H2O
 HA + OH– HA + OH–Hydrolytická rovnováha je definována konstantou Rozsah hydrolýzy aniontu lze vyjádřit stupněm hydrolýzy γ, udávající poměr koncentrací produktu hydrolýzy a původního aniontu: γ = [HA]/cA = [OH-]/cA. Pro rovnovážné koncentrace složek roztoku, konstantu a stupeň hydrolýzy pak platí: Je-li stupeň hydrolýzy malý (γ « 1), lze v rovnici (50) považovat výraz (1-γ) » 1 a získá se tím vztah pro výpočet přibližné hodnoty stupně hydrolýzy Stupeň hydrolýzy umožňuje výpočet pH, neboť pOH = –log (cA·γ): Ze vztahu (48) také vyplývá, že v případě malé hydrolýzy aniontu, tj. [A–] » cA, lze konstantu vyjádřit pomocí celkové koncentrace aniontu (soli): Odtud lze snadno odvodit vztah pro výpočet pH:
Jiný způsob výpočtu pH vychází z předpokladu, že anion podléhající hydrolýze je slabou zásadou. Hodnotu pOH roztoku, jak vyplývá též ze vztahu (48a), lze vypočítat za použití konstanty bazicity konjugované zásady ze vztahu (56) příp. z kvadratické rovnice (37b) na základě podmínek přesnosti v kapitole 5.3.2. Převod pOH na pH se provede obvyklým způsobem. Řešené příklady:
| ||
| |||||