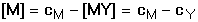Řešení: a) Při nadbytku kovového iontu lze u stabilních komplexů předpokládat, že veškerý ligand je vázán do komplexu: cY = [MY], a tedy
cY = 50·0,01/150 = 3,33·10–3 mol·l-1
[Cu2+] = 3,34·10–3 mol·l-1 = 10–2,48
mol·l-1 ....... pCu = 2,48
b) Koncentrace komplexotvorných složek je stejná
Protože konstanta stability komplexu je poměrně vysoká, lze použít vztahu (8):
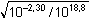 = 10-10,55
mol·l-1 = 2,82·10-11
mol·l-1 = 10-10,55
mol·l-1 = 2,82·10-11
mol·l-1
Výsledek pCu = 10,55 je správný, neboť [Cu2+] « cCu. c) Ligand je v nadbytku. Lze-li zanedbat disociaci komplexu (u stabilních komplexů je to možné), rovnovážnou koncentraci ligandu vypočítáme ze vztahu (6) a rovnovážnou koncentraci kovového iontu ze vztahu (5):
cY = 110·0,01/210 = 5,24·10–3 mol·l-1
= 10–2,28 mol·l-1
[Y] = cY – cM = 4,8·10–4 mol·l-1 =
10–3,32 mol·l-1
[Cu2+] =
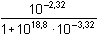 = 10-17,8
mol·l-1 = 1,58·10-18
mol·l-1 = 10-17,8
mol·l-1 = 1,58·10-18
mol·l-1Koncentrace měďnatých iontů je: a) pCu = 2,48; b) pCu = 10,55; c) pCu = 17,8. | ||