| |||||
|
Smísením roztoků kovového iontu M a ligandu L se po jisté době ustaví rovnováha M + n L Koncentrace vzniklého komplexu a obou jeho složek jsou určeny stabilitou komplexu, kterou charakterizuje konstanta stability Rovnovážná koncentrace kovového iontu [M], kterou nejčastěji při reakcích zjišťujeme, je obvykle velmi nízká, proto se vyjadřuje v logaritmickém tvaru: pM = – log [M]. 6.1. Rovnováha při vzniku komplexu ML Při vzniku jednoduchého a současně jediného komplexu ML ustaví se rovnováha definovaná konstantou stability Ze vztahu (3) a celkové koncentrace kovového iontu je pak možno vypočítat rovnovážnou koncentraci centrálního iontu M: Rovnovážná koncentrace ligandu je vyjádřena rozdílem celkových koncentrací složek: Pokud při tvorbě komplexu ML jsou koncentrace složek stejné, tj. cM = cL a tím také [M] = [L], pak podle (4) platí cM = [M](1 + β1[L]) = [M](1 + β1[M]) a úpravou se obdrží kvadratická rovnice (7), jejíž kladný kořen je hodnota [M]: U velmi stabilních komplexů je [M] « cM, a tedy lze v tomto případě lineární člen [M] v rovnici (7) zanedbat, čímž se získá jednoduchý vztah Koncentrace M je zpravidla velmi nízká hodnota, proto se v praxi používá logaritmického tvaru: pM = log[M]. Řešené příklady:
| ||
| |||||

 MLn
MLn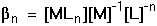
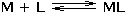
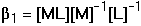
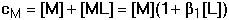
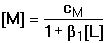
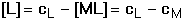
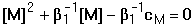
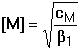
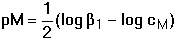 (8)
(8)


