Řešení: Celkové koncentrace složek:
cNH3 = 1,00 mol·l-1
Celkové konstanty stability (10): β1 = 102,4, β2 = 104,9, β3 = 107,4, β4 = 109,6 Rovnovážná koncentrace ligandu: [NH3] = cNH3 - 4cZn = 0,96 mol·l-1 Protože cNH3 » 4cZn, lze předpokládat komplex Zn(NH3)42+ za zcela převažující a lze tedy pro výpočet rovnovážné koncentrace zinečnatých iontů použít vztahu (12):
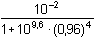 = 10-11,53 =
2,95·10-12 mol·l-1 = 10-11,53 =
2,95·10-12 mol·l-1
 pZn = 11,53 pZn = 11,53
Rovnovážná koncentrace Zn2+-iontů v roztoku je 2,95·10–12 mol·l-1. | ||