Řešení: Amoniak je v nadbytku, lze tedy jako převažující komplex očekávat Cu(NH3)42+. Nejdříve je nutno vypočítat rovnovážnou koncentraci amoniaku:
Koncentrace měďnatých iontů podle (12):
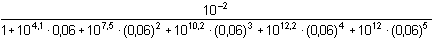 = =
=
[Cu2+] ≈ 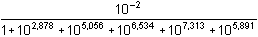 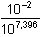 =
10-9,396 mol·l-1 =
4,02·10-10 mol·l-1
pCu = 9,40 =
10-9,396 mol·l-1 =
4,02·10-10 mol·l-1
pCu = 9,40
Koncentrace dalších složek roztoku podle (13):
[Cu(NH3)22+] = 10-9,40 · 107,50 · 10–2,44 = 10–4,34 mol·l-1 = 4,57·10–5 mol·l-1
[Cu(NH3)32+] = 10-9,40 · 1010,2 · 10–3,66 = 10–2,86 mol·l-1 = 1,38·10–3 mol·l-1
[Cu(NH3)42+] = 10-9,40 · 1012,2 · 10–4,88 = 10–2,08 mol·l-1 = 8,32·10–3 mol·l-1
[Cu(NH3)52+] = 10-9,40 · 1012,0 · 10–6,10 = 10–3,50 mol·l-1 = 3,16·10–4 mol·l-1
V roztoku převažují komplexy typu ML4, méně je ML3 a ML5, koncentrace zbývajících komplexů ML2 a ML je zanedbatelná. | ||