Řešení: a) Celková rovnovážná koncentrace SO42--iontů je tvořena roztokem síranu sodného a příspěvkem disociovaného síranu vápenatého:
Podle vztahu (8) pro součin rozpustnosti platí:
[SO42-]2dis +
0,001·[SO42-]dis - Ks = 0
[SO42-]dis =
2,56·10-3 mol·l-1
= [Ca2+] = [CaSO4]
[Ca2+] =
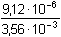 =
2,56·10-3 mol·l-1 =
[CaSO4] =
2,56·10-3 mol·l-1 =
[CaSO4]Zanedbá-li se podíl disociace síranu vápenatého, obdrží se podle (10) výsledek [SO42-] = 9,12·10-3 mol·l-1, který je výrazně vyšší než předchozí. Podíl disociace v tomto případě tedy není zanedbatelný! b) Kladný kořen kvadratické rovnice (viz případ a))
má hodnotu [SO42-]dis = 1,817·10-4 mol·l-1 « 0,05 mol·l-1. Podíl síranových iontů z disociace síranu vápenatého je zanedbatelný vzhledem ke koncentraci síranu sodného a lze rozpustnost počítat podle vztahu (10):
| ||