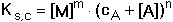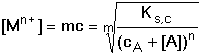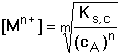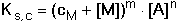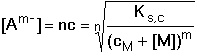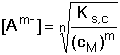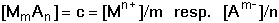|
7.2. Vliv vlastních iontů na rozpustnost
Zvětší-li se koncentrace jednoho z iontů tvořících nerozpustnou sraženinu, koncentrace druhého
iontu musí klesnout - hodnota součinu rozpustnosti musí zůstat zachována.
Bude-li sraženina MmAn rozpuštěna v nadbytku iontu Am-
(koncentrace cA), bude celková koncentrace aniontu zahrnovat také příspěvek koncentrace
z disociace sraženiny [A]celk. = cA + [A] a pro součin rozpustnosti bude
platit
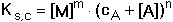 (8) (8)
Koncentraci iontu Mn+ pak vypočítáme ze vztahu
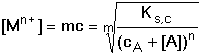 (9) (9)
Obvykle však bývá cA » [A] a lze tedy považovat [A]celk. ≈
cA. Tím se vztah (9) zjednoduší
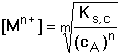 (10) (10)
Bude-li sraženina MmAn rozpuštěna v nadbytku iontů Mn+
(koncentrace cM), vztahy budou analogické s předchozími
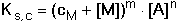 (11) (11)
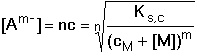 (12a) (12a)
resp.
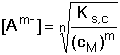 pro cM » [M] (12b)
pro cM » [M] (12b)
Na základě uvedených rovnic lze rozpustnost sloučeniny vyjádřit následujícími vztahy:
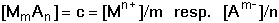 (13) (13)
Řešené příklady:
- Příklad 7.26

- Jaká je rozpustnost síranu barnatého a) ve vodě, b) v roztoku síranu draselného koncentrace
0,01 mol·l-1? Ks = 1,10·10-10
- Příklad 7.27

- Jaká je rozpustnost síranu vápenatého v roztoku síranu sodného koncentrace a) 0,001
mol·l-1, b) 0,05 mol·l-1 ? Ks =
9,12·10-6
- Příklad 7.28

- Kolikrát se zmenší koncentrace hořečnatých iontů v nasyceném roztoku hydroxidu hořečnatého
(Ks = 1,12·10-11), jestliže se koncentrace OH–-iontů
zvětší 12krát?
- Příklad 7.29

- Jaká hodnota pH je nezbytná pro vznik sraženiny Mg(OH)2, je-li koncentrace
hořečnatých iontů 0,01 mol·l-1 ? Ks = 1,12·10-11
- Příklad 7.30

- Jaká musí být koncentrace uhličitanu sodného, aby z nasyceného roztoku síranu barnatého
se začala vylučovat sraženina BaCO3? Ks(BaSO4) =
1,1·10-10, Ks(BaCO3) = 5,13·10-9
- Příklad 7.31

- K roztoku obsahující barnaté a vápenaté ionty (cBa = cCa = 0,02
mol·l-1) je postupně přidáván roztok síranu sodného. Při jaké koncentraci
síranu se bude selektivně srážet síran barnatý a jaké množství Ba2+-iontů zůstane
v roztoku nevysráženo? Ks(CaSO4) = 9,12·10-6,
Ks(BaSO4) = 1,10·10-10, Mr(Ba) = 137,34
- Příklad 7.32

- Roztok olovnatých a manganatých iontů (cPb = cMn = 0,01
mol·l-1) byl nasycen sulfanem (c(H2S) = 0,1
mol·l-1). V jaké koncentračním rozmezí sulfidu a pH se bude selektivně srážet
sulfid olovnatý? Ks(PbS) = 2,51·10-27, Ks(MnS) =
2,51·10-13, disociační konstanty H2S: pK1 = 7,07,
pK2 = 12,20
|
|