Řešení: a) Pro vznik sraženiny PbS je třeba sulfidový ion o koncentraci:
Protože sulfan je ve vodném prostředí kyselinou, potřebná koncentrace sulfidu bude určena aciditou roztoku:
 2 H3O+ + S2-
2 H3O+ + S2-
Konstanta, charakterizující tuto celkovou disociaci sulfanu, je definována vztahem
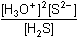 = K1·K2
= 10-19,27 = K1·K2
= 10-19,27
z něhož pro koncentraci H3O+ vyplývá
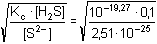 = 102,16
mol·l-1 = 102,16
mol·l-1
b) Pro vznik sraženiny MnS je třeba sulfidový ion o koncentraci:
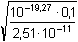 = 10-4,83
mol·l-1 = 10-4,83
mol·l-1
Sulfid olovnatý se bude selektivně srážet v koncentračním rozmezí sulfidu 2,51·10-25 až 2,51·10-11 mol·l-1, což v případě roztoku nasyceného sulfanem bude v oblasti pH -2,16 až 4,83. | ||