|
- Příklad 8.12
- Vypočtěte rovnovážnou konstantu pro redoxní reakci manganistanu s železnatými ionty při pH 2
a rozhodněte, zda průběh reakce je kvantitativní!
E°Fe3+/Fe2+ = 0,771 V,
E°MnO4-/Mn2+ = 1,51 V.
Řešení:
Reakce probíhá podle rovnice
MnO4- + 5 Fe2+ + 8 H3O+
 Mn2+ + 5 Fe3+ + 12 H2O Mn2+ + 5 Fe3+ + 12 H2O
Standardní potenciál není závislý na pH, proto je nezbytné v případě redoxního páru
MnO4-/Mn2+ použít hodnoty formálního potenciálu
Ef = 1,51 – (8 · 0,059/5)· pH = 1,510 – 0,189 = 1,321 V
Podle vztahu
(13)
log Kr = 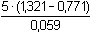 =
46,61 =
46,61
Rovnovážná konstanta reakce při pH 2 má hodnotu Kr = 1046,61, průběh reakce
je kvantitativní.
Zpět
|
|
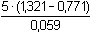 =
46,61
=
46,61
 Mn2+ + 5 Fe3+ + 12 H2O
Mn2+ + 5 Fe3+ + 12 H2O