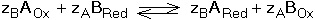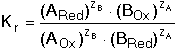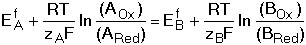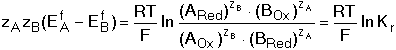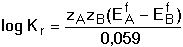| |||||
|
8.3. Posouzení průběhu reakce dvou redoxních párů Z hlediska kvantitativního využití vzájemné reakce dvou redoxníxh párů je nezbytné, aby rovnováha, která se ustavuje mezi složkami systému, byla výrazně posunuta ve směru žádaných produktů reakce. Rovnovážná konstanta oxidačně-redukční reakce vyjádřená aktivitami složek v homogenním roztoku by měla dosáhnout hodnoty 106 pro průběh jednoelektronové reakce z 99,9% ve prospěch produktu. Lze ji vypočítat pomocí formálních, resp. standardních potenciálů parciálních redoxníxh dějů na základě rovnosti potenciálů obou systémů při dosažení rovnováhy Matematickou úpravou rovnice (21) lze odvodit vztah pro výpočet rovnovážné konstanty reakce kde součin počtu elektronů zAzB je jejich nejmenším společným násobkem. Ze vztahu (13) je zřejmé, že využitelnost redoxní reakce bude určována rozdílem hodnot potenciálů (EfA - EfB ). Má-li mít reakce kvantitativní průběh, t.j. rovnovážná konstanta Kr ≥ 106, musí být minimální rozdíl formálních potenciálů 0,360 V při zA = zB = 1; při zA = zB = 2 je reakce využitelná již při 0,180 V atd. Pokud neprobíhají v systému vedlejší reakce, pak Ef = E° a lze počítat s hodnotami standardních potenciálů. Řešené příklady:
| ||
| |||||