Řešení: V roztoku probíhá reakce
 Fe3+ + Ag
Fe3+ + Ag
Po ustavení rovnováhy bude platit
Rovnovážná konstanta (13)
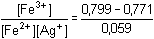 = 0,474 = 0,474
má nízkou hodnotu, rovnováha je posunuta ve směru reakčních složek. Výpočet koncentrací složek systému:
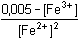 = 100,474 = 2,98 = 100,474 = 2,98
2,98 [Fe2+]2 + [Fe2+] – 0,005 = 0
[Fe2+] = [Ag+] = 4,93·10–3 mol·l-1
[Fe3+] = (5 – 4,93)·10–3 = 7·10–5
mol·l-1
Po ustavení rovnováhy zůstane v roztoku 4,93·10–3 mol·l-1 iontů stříbrných a železnatých, reakcí vznikne pouze 7·10–5 mol·l-1 iontů železitých. | ||