|
- Příklad 8.21
- Určete redox potenciály při titraci objemu 100 ml 0,1 molárního roztoku železnaté soli
v prostředí 1M-H2SO4 po přídavcích 0 ml, 10 ml, 50 ml, 100 ml a 110 ml
titračního okyseleného roztoku ceričité soli rovněž koncentrace 0,1 mol·l-1.
Koncentrace kyseliny a aktivitní koeficienty reagujících složek se během titrace nebudou měnit!
EfFe3+/Fe2+ = 0,680 V;
EfCe4+/Ce3+ = 1,440 V
Řešení:
Při titraci probíhá reakce
Fe2+ + Ce4+  Fe3+ + Ce3+
Fe3+ + Ce3+
a) a = 0
E = 0,680 + 0,059 log 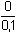 = -
∞ V = -
∞ V
V roztoku se naměří vždy reálná hodnota, neboť roztok železnaté soli obsahuje vždy stopy
železitých iontů.
b) a = 0,1
E = 0,680 + 0,059 log 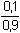 = 0,680 - 0,056 =
0,624 V = 0,680 - 0,056 =
0,624 V
nebo
[Fe3+] = 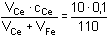 = 9,09·10-3
mol·l-1 = 9,09·10-3
mol·l-1
[Fe 2+] = 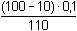 = 8,18·10 -2
mol·l -1
c) a = 0,5
[Fe3+] = [Fe2+]
E = Ef = 0,680 V
d) a = 1
Podle
(15):
E ekv = 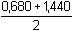 =
1,060 V
e) a = 1,1
Podle
(16):
E = 1,440 + 0,059 log 0,1 = 1,381 V
nebo
[Ce3+] = 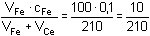 = 4,76·10-2
mol·l-1 = 4,76·10-2
mol·l-1
[Ce 4+] = 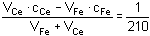 = 4,76·10 -3
mol·l -1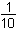 =
1,381 V =
1,381 V
Zpět
| | |
| |
 Fe3+ + Ce3+
Fe3+ + Ce3+
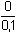 = -
∞ V
= -
∞ V
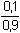 = 0,680 - 0,056 =
0,624 V
= 0,680 - 0,056 =
0,624 V
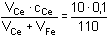 = 9,09·10-3
mol·l-1
= 9,09·10-3
mol·l-1
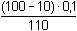 = 8,18·10-2
mol·l-1
= 8,18·10-2
mol·l-1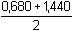 =
1,060 V
=
1,060 V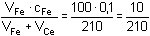 = 4,76·10-2
mol·l-1
= 4,76·10-2
mol·l-1
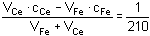 = 4,76·10-3
mol·l-1
= 4,76·10-3
mol·l-1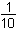 =
=